Механизмы развития дисфункции нервно-мышечных синапсов при боковом амиотрофическом склерозе
- Авторы: Хабибрахманов А.Н.1, Ахмадиева Л.А.1, Нагиев К.К.1, Мухамедьяров М.А.1
-
Учреждения:
- Казанский государственный медицинский университет
- Выпуск: Том 19, № 1 (2025)
- Страницы: 53-61
- Раздел: Обзоры
- Статья получена: 07.12.2023
- Статья одобрена: 11.12.2023
- Статья опубликована: 03.04.2025
- URL: https://annaly-nevrologii.com/pathID/article/view/1070
- DOI: https://doi.org/10.17816/ACEN.1070
- ID: 1070
Цитировать
Аннотация
Боковой амиотрофический склероз (БАС) является прогрессирующим нейродегенеративным заболеванием, характеризующимся гибелью верхних и нижних мотонейронов. В многочисленных исследованиях показано, что структурно-функциональные нарушения нервно-мышечных синапсов (НМС) при БАС развиваются уже на досимптомной стадии болезни. Поражение НМС является самостоятельным и одним из первичных патогенетических процессов при БАС. Цель обзора — анализ научных данных о характере поражения и механизмах нарушения функционирования НМС на пре- и постсинаптическом уровне при БАС у пациентов и в модели данного заболевания на трансгенных животных. Кроме того, представлены сведения о дисфункции перисинаптических шванновских клеток и о нарушении механизмов взаимодействия мотонейрона и скелетной мышцы при БАС. Особое внимание уделено анализу научных работ, связанных с коррекцией молекулярных механизмов, лежащих в основе дисфункции и деструкции НМС при БАС. Сделан вывод о том, что НМС может выступать потенциальной мишенью для разработки новых терапевтических подходов при БАС.
Полный текст
Введение
Боковой амиотрофический склероз (БАС) — это фатальное, прогрессирующее нейродегенеративное заболевание, характеризующееся гибелью верхних и нижних мотонейронов [1]. Чаще всего БАС дебютирует с фокальной мышечной слабости и гипотрофии с последующим распространением на соседние миотомы вдоль цереброспинальной оси. Примерно в 1/3 случаев заболевание начинается с поражения бульбарной мускулатуры, в 2/3 случаев — с поражения мышц конечностей [2, 3]. По мере прогрессирования БАС приводит к атрофии и параличу скелетных мышц, включая диафрагму. Средняя продолжительность жизни с момента установления диагноза составляет 3 года [4]. Классический вариант БАС характеризуется комбинированным поражением верхнего и нижнего мотонейронов на одном или нескольких уровнях цереброспинальной оси, тогда как при атипичных вариантах, таких как первичный боковой склероз, отмечается преимущественное/изолированное поражение верхнего или нижнего мотонейрона [2, 5].
БАС рассматривается как многофакторное заболевание, в инициации и развитии которого имеют значение факторы внешней среды, генетические факторы, процессы естественного старения [6–9].
Существуют гипотезы, объясняющие развитие и распространение нейродегенеративного процесса при БАС. Согласно «нисходящей» гипотезе одним из начальных событий является повышение возбудимости верхнего мотонейрона, что ведёт к развитию глутаматной эксайтотоксичности и вовлечению в патологический процесс нижнего мотонейрона [10–12]. Согласно «восходящей» гипотезе важная роль в инициации и развитии нейродегенеративного процесса отводится нервно-мышечному синапсу (НМС), скелетной мышце и дистальной части аксона [9, 13, 14]. Альтернативная гипотеза предполагает, что верхний и нижний мотонейроны поражаются независимо друг от друга [15, 16]. Поражение НМС считается самостоятельным и одним из первичных патогенетических процессов при БАС [9, 17, 18].
Цель обзора — анализ научных данных о характере поражения и механизмах нарушения функционирования НМС на пре- и постсинаптическом уровне при БАС у пациентов и в модели данного заболевания на трансгенных животных.
Cтроение нервно-мышечного синапса
НМС представляет собой специализированный контакт между окончанием аксона мотонейрона и скелетным мышечным волокном. НМС покрыт перисинаптическими шванновскими клетками (ПШК), участвующими в поддержании структурных и функциональных свойств синапса. Cчитается, что все 3 элемента НМС (нервное окончание, постсинаптическая мембрана, шванновская клетка) вовлечены в патогенез БАС [9, 11].
Мотонейрон и иннервируемые им мышечные волокна вместе формируют единую функциональную структуру — двигательную единицу (ДЕ). В зависимости от скорости сокращения мышечного волокна и его устойчивости к утомлению ДЕ подразделяют на медленные (S), быстрые неутомляемые (FR), быстрые утомляемые (FF) [19, 20]. FR- и FF-волокна иннервируются быстрыми мотонейронами, S-волокна — медленными. Быстрые мотонейроны имеют бóльшие размер сомы и диаметр аксона, более разветвлённое дендритное дерево, меньшую возбудимость, высокую частоту генерации потенциала действия, более быструю проводимость по аксону [21–24]. В экспериментах на мышах с моделью БАС показано, что поражение FF-ДЕ выявляется уже на досимптомной стадии [25], признаки поражения FR-ДЕ отмечаются при развитии клинической картины, в то время как S-ДЕ поражаются на поздней стадии патологии [26].
Поражение нервно-мышечных синапсов и двигательных единиц у пациентов
Имеется немало доказательств поражения НМС на ранних сроках заболевания как у пациентов с БАС, так и в многочисленных моделях БАС. Исследования мышечных биоптатов у пациентов с БАС выявили заметную фрагментацию концевых пластин и их денервацию [27]. С помощью электронной микроскопии у пациентов с БАС показано уменьшение размеров пре- и постсинаптических областей, а также количества митохондрий в нервных окончаниях [28]. У пациентов с БАС также снижена экспрессия субъединиц ацетилхолиновых рецепторов в постсинаптической мембране [29]. При изучении мышечных биоптатов выявлено изменение соотношения мышечных волокон в виде преобладания медленных мышечных волокон, что свидетельствует об избирательной уязвимости быстрых ДЕ [30]. Электрофизиологические исследования также подтверждают преимущественное поражение быстрых ДЕ [31]. Исключением являются экстраокулярные мышцы, которые при БАС интактны [32].
При БАС у пациентов денервация НМС и ретракция аксонов могут опережать дегенерацию мотонейронов и происходить на этапе, когда мотонейроны спинного мозга и передние корешки остаются интактными [33]. Поражение НМС при БАС у человека подтверждается электрофизиологическими методами исследования — показано снижение амплитуды миниатюрных потенциалов концевой пластинки и снижение квантового состава потенциалов концевой пластинки в мышечных биоптатах пациентов с БАС на ранних этапах болезни [34].
Моделирование бокового амиотрофического склероза в трансгенных моделях
Моделирование БАС на животных позволило значительно расширить возможности изучения механизмов патогенеза и разработки способов терапии данного заболевания. В качестве модельных объектов для исследования БАС обычно используют линии трансгенных мышей, экспрессирующих мутантные гены человека, связанные с развитием данного заболевания. С целью изучения БАС был создан ряд трансгенных мышиных моделей с мутациями в генах, связанных с развитием БАС, — SOD1, FUS, C9orf72, TARDBP [9, 35]. Данные модели в целом адекватно воспроизводят клиническую картину БАС, основные патогенетические механизмы и являются эффективным инструментом для изучения болезни.
Мутация гена SOD1, кодирующего супероксиддисмутазу 1, стала первой идентифицированной генетической причиной БАС [36]. Первой трансгенной мышиной моделью БАС стала линия мышей, экспрессирующих мутантный человеческий ген SOD1, продуктом которого был белок с заменой G93A [37]. Данная модель является одной из самых изученных, активно используется в доклинических исследованиях, а также способствовала внедрению рилузола и эдаравона в терапию БАС [35]. SOD1(G93A)-модель воспроизводит большинство механизмов патогенеза БАС, демонстрирует прогрессирующую дегенерацию мотонейронов, приводящую к параличу и смерти трансгенных мышей в возрасте 4–5 мес [37].
Одна из широко применяемых моделей БАС — трансгенная, связанная с экспрессией мутантного гена FUS (fused in sarcoma). Ген FUS кодирует РНК/ДНК-связывающий белок FUS, характеризующийся ядерной локализацией [38]. Первые трансгенные модели БАС, основанные на экспрессии FUS, появились в начале 2010-х гг. [39–41]. Трансгенные FUS-мыши воспроизводят такие патологические процессы при БАС у человека, как накопление внутриклеточных FUS-агрегатов, прогрессирующая гибель мотонейронов, денервация скелетных мышц с развитием параличей и атрофий [42].
Существует трансгенная модель БАС, связанная с экспрессией мутантного гена TARDBP, который кодирует ДНК/РНК-связывающий белок TDP-43 [43]. Посмертные изменения тканей пациентов с БАС включают в себя поражённые нейроны и глию головного и спинного мозга, характеризующиеся потерей ядерного TDP-43 и накоплением нерастворимого фосфорилированного TDP-43 в цитоплазме [8]. Создано несколько TDP-43 моделей БАС, при этом получены различные фенотипы [9, 44].
Разработана генетическая модель БАС, основанная на экспрессии мутантного гена C9ORF72. Он кодирует белок, содержащийся в нейронах и других клетках, участвующий в передаче сигналов в нервной системе [9]. Модели БАС на мышах, экспрессирующие человеческие повторы C9ORF72, демонстрируют различные патологические, функциональные и поведенческие характеристики заболевания [45].
Пресинаптические нарушения в нервно-мышечных синапсах
SOD1-модель
У SOD-1 мышей поражение НМС наблюдается уже на досимптомной стадии, опережая появление первых признаков патологии в мотонейронах [46, 47]. Ещё до явных признаков денервации НМС на досимптомной стадии отмечаются изменение морфологии нервных терминалей, а также вакуолизация и набухание митохондрий с уменьшением их количества в пресинаптической мембране [46, 47]. В первую очередь изменения возникают в FF-ДЕ [26, 46–48]. Данная модель воспроизводит ряд основных патогенетических механизмов развития БАС, таких как нарушение аксонального транспорта и развитие митохондриальной дисфункции. Подобные нарушения, а также уменьшение количества синаптических везикул в SOD1-модели развиваются на досимптомной стадии избирательно в FF-ДЕ, в то время как FR- и S-ДЕ остаются интактными [26]. Поражение FR-ДЕ становится явным на ранней симптомной стадии, а S-ДЕ — на поздней симптомной [26].
В данной модели может отмечаться нарушение экспрессии синаптических белков. У SOD1-мышей на досимптомной стадии нами выявлено значительное снижение экспрессии таких пресинаптических белков, как SNAP-25 и синапсин-1, а на симптомной стадии, в дополнение к этому, отмечалось достоверное снижение экспрессии синаптофизина [49]. Среди изученных нами пресинаптических белков наиболее выраженное изменение касалось SNAP-25, экспрессия которого снижалась на ~50% в сравнении с мышами дикого типа [49]. Возможной причиной такой уязвимости SNAP-25 может быть чувствительность данного белка к окислительному стрессу [50]. Окислительный стресс в пресинаптической мембране также развивается на досимптомной стадии вследствие снижения числа и нарушения морфологии митохондрий [51]. Из-за нарушенного аксонального транспорта мотонейрон не может компенсировать митохондриальную дисфункцию в нервной терминали [26].
В этой же модели БАС выявляются нарушения передачи НМС. У SOD1-мышей снижен квантовый состав потенциалов концевой пластинки и замедлено рециклирование синаптических везикул на досимптомной и симптомной стадиях патологии [52]. Отмечается изменение амплитуды и частоты миниатюрных потенциалов концевой пластинки, при этом в первую очередь нарушение синаптической передачи становится явным в FF-ДЕ [25]. В данной модели также нарушен докинг синаптических везикул к пресинаптической мембране [46, 47], что может быть следствием нарушения формирования SNARE-комплекса из-за снижения экспрессии SNAP-25 [49].
FUS-модель
В трансгенной модели, сверхэкспрессирующей человеческий ген FUS (hFUS), на досимптомной стадии отмечается денервация НМС с сохранением числа мотонейронов в спинном мозге [53]. В пресинаптической мембране НМС отмечается накопление FUS-агрегатов [53]. При ультраструктурном анализе у FUS-мышей в НМС уменьшено количество синаптических везикул, митохондрий в нервной терминали, нарушена их морфология, в то время как постсинаптическая мембрана остаётся относительно интактной [53]. Однако в другой модели, FUSΔNLS/+, выявлено уменьшение площади постсинаптической мембраны [54]. Избирательная уязвимость быстрых ДЕ тоже характерна для FUS-мышей [55].
В FUS-модели отмечается нарушение экспрессии пресинаптических белков. Так, нами у трансгенных FUS(1-359)-мышей на досимптомной стадии выявлена повышенная экспрессия синаптических белков SNAP-25 и синапсина-1 [17], тогда как на симптомной стадии отмечалось достоверное снижение экспрессии SNAP-25, синапсина-1 и синаптофизина. Возможной причиной усиленной экспрессии некоторых пресинаптических белков на досимптомной стадии может быть стабилизация мРНК вследствие накопления FUS в пресинаптической мембране, что может влиять на локальные процессы трансляции белка в синапсе [56, 57].
В FUS-модели уже на досимптомной стадии наблюдаются нарушения передачи НМС. В FUS(1-359)-модели на досимптомной стадии выявлено снижение амплитуды миниатюрных (спонтанных) и вызванных потенциалов концевой пластинки, а также уменьшение длительности времени нарастания и времени полуспада миниатюрных потенциалов концевой пластинки в сравнении с мышами дикого типа. Кроме того, наблюдались более выраженное снижение амплитуды потенциалов концевой пластинки при высокочастотной активности (20 Гц) и более медленное восстановление данной амплитуды после окончания стимуляции у FUS(1-359)-мышей в сравнении с мышами дикого типа. Кроме того, у FUS(1-359)-мышей наблюдалось снижение интенсивности эндоцитоза синаптических везикул, вызванной высокочастотной стимуляцией синапса (20 Гц), в сравнении с мышами дикого типа [17].
В другой работе у FUS-мышей выявлено снижение амплитуды вызванных моторных ответов, которое опережает морфологические изменения пре- и постсинаптических мембран НМС и аксонов, за которыми следует гибель мотонейронов [55].
Не все трансгенные TDP-43-мыши достоверно воспроизводят нервно-мышечный фенотип с развитием мышечной слабости, амиотрофий и денервации НМС. При этом в модели TDP-43Q331K на досимптомной стадии отмечаются признаки нарушения синаптической передачи в виде увеличения амплитуды и снижения частоты миниатюрных потенциалов концевой пластинки, а также признаки полииннервации НМС [58].
Постсинаптические нарушения в нервно-мышечных синапсах
В постсинаптической мембране в моделях БАС наблюдаются специфические изменения. У трансгенных SOD1-мышей выявлены морфологические изменения в виде укорочения складок концевой пластинки [47]. В SOD1-модели на симптомной стадии нарушена экспрессия важных структурных белков постсинаптической мембраны, таких как нестин, дистрофин, LRP4, рапсин, отвечающих за морфологию концевой пластинки и кластеризацию ацетилхолиновых рецепторов [59].
У FUS-мышей уменьшена площадь постсинаптической мембраны, при этом данные изменения могут выявляться как на досимптомной стадии [54], так и исключительно на симптомной стадии патологии [17]. Вероятной причиной подобных изменений может быть прямое воздействие FUS на экспрессию субъединиц ацетилхолиновых рецепторов при накоплении FUS в подсинаптических ядрах скелетных мышечных волокон [54].
Ранее считалось, что изменения в скелетной мышце носят вторичный характер и являются исключительно следствием дегенерации мотонейронов. Однако ряд исследований свидетельствует об обратном. Так, в случае мутаций в гене SOD1 в скелетной мышце на досимптомной стадии отмечается накопление патологических агрегатов супероксиддисмутазы-1 [60]. Накопление данных агрегатов ведёт к повреждению митохондрий, в результате чего на досимптомной стадии в постсинаптической мембране нарушается морфология и уменьшается количество митохондрий, а также развивается окислительный стресс [51]. В пользу самостоятельной роли скелетной мышцы в патогенезе БАС также свидетельствует тот факт, что, несмотря на предотвращение гибели мотонейронов спинного мозга и сохранение их числа под действием ингибитора p38 MAPK, всё равно развиваются денервация скелетных мышц и их атрофия [46, 61].
Скелетная мышца в рамках патогенеза БАС может выступать и прямым агрессором. Избирательная сверхэкспрессия мутантного SOD1 приводит к поражению НМС, дистальной аксонопатии, а также, вероятно, к поражению кортикоспинального тракта, о чём свидетельствуют развивающиеся гиперрефлексия и спастичность [62]. Влияние скелетной мышцы может быть опосредовано секрецией внеклеточных везикул, которые могут оказывать нейротоксический эффект, негативно влияя на выживаемость мотонейронов и препятствуя росту аксонов [63, 64].
Скелетная мышца может способствовать денервации НМС также путём секреции фактора Nogo-A, который является хеморепеллентом, т. е. веществом, отталкивающим конус роста аксона. Это препятствует эффективной реиннервации НМС и способствует прогрессирующей денервации скелетной мышцы [65]. У пациентов с БАС экспрессия данного фактора повышена, при этом уровень экспрессии коррелирует с темпами прогрессирования заболевания [66]. При этом применение анти-Nogo-A-антител заметно замедляет прогрессирование болезни в модели БАС [67].
У mSOD1-мышей повышен метаболизм скелетных мышц, что приводит к хроническому дефициту энергии, наблюдающемуся до амиотрофий и денервации мышц. Дефицит энергии и повышенный мышечный метаболизм могут приводить к деструкции НМС, денервации скелетных мышц и гибели мотонейронов [68]. Изменение диеты путём повышения содержания жиров в питании позволило увеличить продолжительность жизни и выживаемость мотонейронов у мышей с моделью БАС [69].
Участие перисинаптических шванновских клеток в развитии бокового амиотрофического склероза
Помимо изменений в пре- и постсинаптических компартментах НМС, у пациентов с БАС также отмечаются патологические изменения терминальных ПШК [66]. Морфология данных клеток изменяется, отростки разрастаются и проникают в синаптическую щель, что значительно снижает доступную для нервно-мышечной передачи поверхность постсинаптической мембраны.
В SOD1(G37R)-модели показано, что ПШК не могут вырабатывать адекватный ответ на дегенерацию НМС в виде изменения своего фенотипа на фагоцитарный, а также не способны направлять рост нервных окончаний. Это ухудшает процессы компенсаторной реиннервации и способствует прогрессирующей денервации [70].
В SOD1(G93A)-модели выявлены избирательная потеря ПШК и их инфильтрация макрофагами в быстрых ДЕ на досимптомной стадии [25, 71]. Данное наблюдение также коррелировало со сниженной способностью мотонейронов, иннервирующих быстрые мышечные волокна, к реиннервации. Поражение ПШК отмечено и в TDP43-модели БАС [72].
Помимо этого, в SOD1(G93A)-модели БАС показано, что ПШК в FF-ДЕ способны к экспрессии и секреции хеморепеллента семафорина 3А (Sema3A) de novo, который, как и Nogo-A, отталкивает конус роста аксона и приводит к денервации, способствуя тем самым избирательной уязвимости FF-ДЕ [73]. R. Maimon и соавт. установили, что повышенный уровень Sema3A коррелирует с денервацией мышц, при этом ингибирование экспрессии Sema3A уменьшает выраженность дегенерации НМС и аксонов [74].
О роли ПШК в патогенезе БАС косвенно свидетельствует также тот факт, что применение маситиниба у трансгенных мышей способствовало выживанию ПШК и замедлению болезни [71]. При этом у пациентов с БАС препарат маситиниб в комбинации с рилузолом показал свою достоверную эффективность [75].
Нарушение механизмов взаимодействия мотонейрона и скелетной мышцы
При БАС отмечаются специфические изменения в каждой части НМС — пре- и постсинаптическом компартментах, а также окружающих их ПШК. Подобные изменения неизбежно ведут к нарушению взаимодействия «мотонейрон–скелетная мышца», что, в свою очередь, способствует дальнейшему прогрессированию заболевания. В норме, когда мотонейрон с мышечным волокном образуют функциональный синапс, образованная ДЕ начинает секретировать ряд трофических и ростовых факторов, обеспечивающих выживаемость мотонейронов, рост и регенерацию аксонов, структурную и функциональную стабильность НМС, дифференцировку и сократительные свойства мышечных волокон [76]. Такой секретóм содержит высокие концентрации сосудистого эндотелиального фактора роста, глиального нейротрофического фактора, мозгового нейротрофического фактора, нейротрофинов-3 и -4, инсулиноподобного фактора роста-1 и белка, связывающего инсулиноподобный фактор роста-3. Установлено, что иннервированная скелетная мышца активно экспрессирует мышечно-специфическую микро-РНК miR-206 [77]. Считается, что miR-206 играет протективную роль, обеспечивая выживаемость синаптических контактов и активность спрутинга. Высокий уровень экспрессии miR-206 у пациентов с БАС связан с более медленным темпом прогрессирования заболевания [78].
При поражении НМС одно из ключевых мест может занимать нарушение работы сигнальной системы «агрин–LRP4–MuSK». Двигательное нервное окончание секретирует агрин и белок-4, связанный с рецептором липопротеинов низкой плотности (LRP4), в то время как скелетной мышцей синтезируются рапсин, мышечно-специфическая тирозинкиназа (MuSK) и адапторный белок Dok-7. Взаимодействие этих факторов обеспечивает нормальную структуру и функционирование НМС [79]. Сигнальная система посредством сложного взаимодействия 3 белков регулирует кластеризацию ацетилхолиновых рецепторов на постсинаптической мембране НМС [80].
К нарушению работы сигнальной системы «агрин–LRP4–MuSK» могут приводить внутренние процессы в скелетной мышце. Так, мышечные волокна, выращенные из индуцированных плюрипотентных клеток, полученных от пациентов с БАС, не формируют функциональные НМС с аксонами здоровых мотонейронов, а в ответ на секретируемый агрин не происходит кластеризация ацетилхолиновых рецепторов на постсинаптической мембране [30]. Нарушение функционирования и целостности ДЕ в таком случае неизбежно будет приводить к дефициту нейротрофических и ростовых факторов, что будет только способствовать дальнейшему прогрессированию болезни [76]. В С9orf72-модели БАС показано, что образованные вследствие мутации поли(GA)-пептиды ингибируют работу сигнальной системы «агрин–LRP4–MuSK», что приводит к нарушению нервно-мышечной передачи и повреждению пре- и постсинаптической мембраны НМС [81]. В SOD1(G93A)-модели обнаружено нарушение транспортировки MuSK в постсинаптическую мембрану, что приводит к поражению НМС [82].
Активация и нормализация сигнальной системы «агрин–LRP4–MuSK» может положительно сказываться на течении БАС. Например, гиперэкспрессия агрина в TDP-43-модели может предотвращать гибель мотонейронов и сохранять НМС интактными [83]. Активация MuSK в данной сигнальной системе также оказывает положительный эффект, замедляя денервацию, стимулируя выживаемость мотонейронов, увеличивая продолжительность жизни SOD1(G93A)-трансгенных мышей [84–86]. Активация Dok7 в сигнальной системе также оказывает положительный эффект в виде уменьшения выраженности дегенерации НМС и атрофии мышц, продлевает жизнь и улучшает двигательные навыки в SOD1(G93A)-трансгенной модели [87].
Заключение
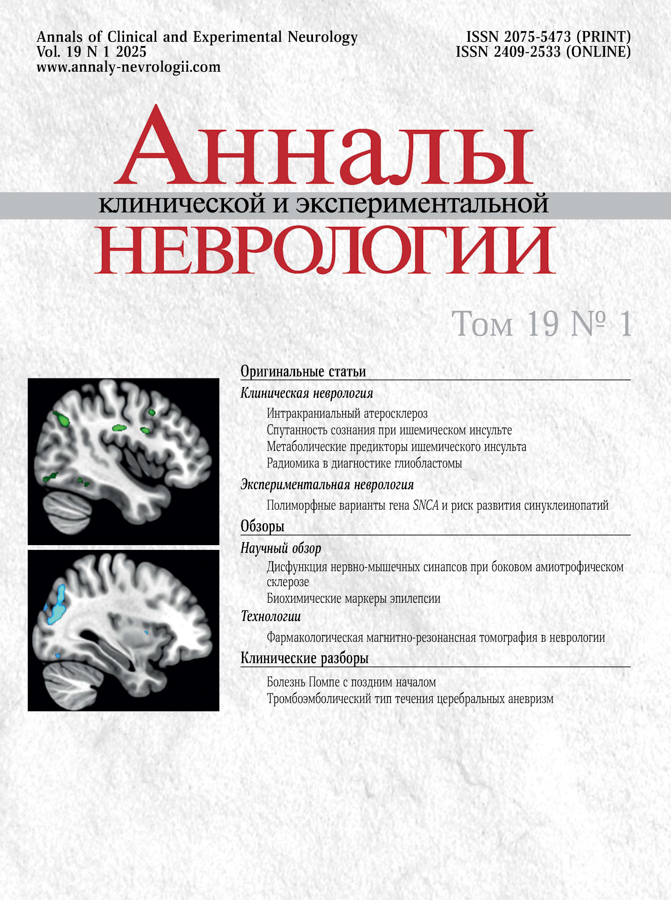
Поражение НМС при БАС является самостоятельным и ранним звеном патогенеза заболевания, о чём свидетельствуют данные, полученные в исследованиях как на трансгенных моделях заболевания, так и на пациентах с БАС (рисунок). Важно отметить, что уже на досимптомной стадии патологии в моделях БАС отмечается ряд функциональных и структурных нарушений НМС. Во всех моделях, в которых установлена денервация НМС, показана избирательная уязвимость FF-ДЕ на ранних стадиях патологии. Во многих моделях показано, что пресинаптический компартмент является более уязвимым, чем постсинаптический. Выявленные функциональные нарушения НМС при патологии БАС (по данным, полученным на трансгенных моделях) свидетельствуют о снижении надёжности нервно-мышечной передачи возбуждения как при редкочастотной, так и при высокочастотной активности. Структурные нарушения НМС при БАС заключаются в уменьшении площади и фрагментации синаптических контактов, изменении экспрессии ряда синаптических белков и других нарушениях.
Патогенетические механизмы развития дисфункции НМС при БАС и в модели данного заболевания.
Изображение создано при помощи сервиса BioRender.com.
Особое внимание привлекает выяснение и возможность коррекции молекулярных механизмов, лежащих в основе дисфункции и деструкции НМС при БАС. НМС может выступать потенциальной мишенью для разработки новых терапевтических подходов при БАС. В представленном обзоре показан целый ряд достаточно успешных попыток модуляции сигнальных путей, нарушенных в системе «мотонейрон–скелетная мышца» в моделях БАС [65–67, 73, 74, 77, 78].
Основываясь на результатах, полученных на трансгенных животных, можно предположить, что терапевтические методы, направленные на повышение экспрессии агрина и miR-206, активацию MuSK, подавление экспрессии Sema3 и Nogo-A, потенциально могут быть достаточно эффективными при БАС. Помимо дальнейшего изучения терапевтического потенциала модуляции вышеуказанных молекул, можно порекомендовать изучить возможность их комбинации с уже используемыми лекарственными средствами (рилузол, эдаравон) для повышения эффективности терапии БАС.
Об авторах
Айдар Назимович Хабибрахманов
Казанский государственный медицинский университет
Email: marat.muhamedyarov@kazangmu.ru
ORCID iD: 0000-0001-5625-8658
м. н. с. Института нейронаук
Россия, 420012, Казань, ул. Бутлерова, д. 49Ляйсан Айдаровна Ахмадиева
Казанский государственный медицинский университет
Email: marat.muhamedyarov@kazangmu.ru
ORCID iD: 0009-0000-4926-3192
м. н. с. Института нейронаук
Россия, 420012, Казань, ул. Бутлерова, д. 49Керим Казбекович Нагиев
Казанский государственный медицинский университет
Email: marat.muhamedyarov@kazangmu.ru
ORCID iD: 0009-0000-1577-9780
ассистент каф. нормальной физиологии
Россия, 420012, Казань, ул. Бутлерова, д. 49Марат Александрович Мухамедьяров
Казанский государственный медицинский университет
Автор, ответственный за переписку.
Email: marat.muhamedyarov@kazangmu.ru
ORCID iD: 0000-0002-0397-9002
д-р мед. наук, профессор, зав. каф. нормальной физиологии, директор Института нейронаук
Россия, 420012, Казань, ул. Бутлерова, д. 49Список литературы
- Hardiman O, Al-Chalabi A, Chio A, et al. Amyotrophic lateral sclerosis. Nat Rev Dis Primers. 2017;3:17071. doi: 10.1038/nrdp.2017.71
- Хондкариан О.А., Бунина Т.Л., Завалишин И.А. Боковой амиотрофический склероз. М.; 1978. 264 c. Khondkarian OA, Bunina TL, Zavalishin IA. Amyotrophic lateral sclerosis. Moscow; 1978. 264 p. (In Russ.)
- Körner S, Kollewe K, Fahlbusch M, et al. Onset and spreading patterns of upper and lower motor neuron symptoms in amyotrophic lateral sclerosis. Muscle Nerve. 2011;43(5):636–642. doi: 10.1002/mus.21936
- Traxinger K, Kelly C, Johnson BA, et al. Prognosis and epidemiology of amyotrophic lateral sclerosis: analysis of a clinic population, 1997–2011. Neurol Clin Pract. 2013;3(4):313–320. doi: 10.1212/CPJ.0b013e3182a1b8ab
- Grad LI, Rouleau GA, Ravits J, Cashman NR. Clinical spectrum of amyotrophic lateral sclerosis (ALS). Cold Spring Harb Perspect Med. 2017;7(8):a024117. doi: 10.1101/cshperspect.a024117
- Мухамедьяров М.А., Хабибрахманов А.Н., Зефиров А.Л. Ранние дисфункции при боковом амиотрофическом склерозе: патогенетические механизмы и роль в инициации заболевания. Биологические мембраны: журнал мембранной и клеточной биологии. 2020;37(4):264–270. Mukhamedyarov MA, Khabibrakhmanov AN, Zefirov AL. Early dysfunctions in amyotrophic lateral sclerosis: pathogenetic mechanisms and a role in disease initiation of the disease. Biochemistry (Moscow), Supplement Series A: Membrane and Cell Biology. 2020;14(4):261–266. doi: 10.1134/S1990747820030113
- Masrori P, Van Damme P. Amyotrophic lateral sclerosis: a clinical review. Eur J Neurol. 2020;27(10):1918–1929. doi: 10.1111/ene.14393
- Brown RH, Al-Chalabi A. Amyotrophic lateral sclerosis. N Engl J Med. 2017;377(2):162–172. doi: 10.1056/NEJMra1603471
- Мухамедьяров М.А., Петров А.М., Григорьев П.Н. и др. Боковой амиотрофический склероз: современные представления о патогенезе и экспериментальные модели. Журнал высшей нервной деятельности им И.П. Павлова. 2018;68(5):551–566. Mukhamedyarov MA, Petrov AM, Grigoriyev PN et al. Amyotrophic lateral sclerosis: current understanding of the pathogenesis and experimental model. Zh Vyssh Nerv Deiat IP Pavlova. 2018;68(5):551–566. doi: 10.1134/S0044467718050106
- Rothstein JD, Tsai G, Kuncl RW, et al. Abnormal excitatory amino acid metabolism in amyotrophic lateral sclerosis. Ann Neurol. 1990;28(1):18–25. doi: 10.1002/ana.410280106
- Verma S, Khurana S, Vats A, et al. Neuromuscular junction dysfunction in amyotrophic lateral sclerosis. Mol Neurobiol. 2022;59(3):1502–1527. doi: 10.1007/s12035-021-02658-6
- Eisen A., Nakajima M., Weber M. Corticomotorneuronal hyper-excitability in amyotrophic lateral sclerosis. J Neurol Sci 1998;160(Suppl 1):S64–68. doi: 10.1016/S0022-510X(98)00200-7
- Kiernan MC, Vucic S, Cheah BC, et al. Amyotrophic lateral sclerosis. Lancet. 2011;377(9769):942–955. doi: 10.1016/S0140-6736(10)61156-7
- Dadon-Nachum M, Melamed E, Offen D. The “dying-back” phenomenon of motor neurons in ALS. J. Mol. Neurosci. 2011;43(3):470–477. doi: 10.1007/s12031-010-9467-1
- Pamphlett R, Kril J, Hng TM. Motor neuron disease: a primary disorder of corticomotoneurons? Muscle Nerve. 1995;18(3):314–318. doi: 10.1002/mus.880180308
- Attarian S, Vedel J, Pouget J, Schmied A. Progression of cortical and spinal dysfunctions over time in amyotrophic lateral sclerosis. Muscle Nerve. 2008;37(3):364–375. doi: 10.1002/mus.20942
- Mukhamedyarov MA, Khabibrakhmanov AN, Khuzakhmetova VF, et al. Early alterations in structural and functional properties in the neuromuscular junctions of mutant FUS mice. Int J Mol Sci. 2023;24(10):9022. doi: 10.3390/ijms24109022
- Verma S, Khurana S, Gourie-Devi M, et al. Multiomics approach reveal novel insights in FUS driven juvenile amyotrophic lateral sclerosis: a family quartet analysis. Ann Neurosci. 2023. doi: 10.1177/09727531231194399
- Hennig R, Lømo T. Firing patterns of motor units in normal rats. Nature. 1985;314(6007):164–166. doi: 10.1038/314164a0
- Burke RE, Levine DN, Zajac FE, et al. Mammalian motor units: physiological-histochemical correlation in three types in cat gastrocnemius. Science. 1971;174(4010):709–712. doi: 10.1126/science.174.4010.709
- Burke RE, Dum RP, Fleshman JW, et al. An HRP study of the relation between cell size and motor unit type in cat ankle extensor motoneurons. J Comp Neurol. 1982;209(1):17–28. doi: 10.1002/cne.902090103
- Cullheim S, Fleshman JW, Glenn LL, Burke RE. Membrane area and dendritic structure in type‐identified triceps surae alpha motoneurons. J Comp Neurol. 1987;255(1):68–81. doi: 10.1002/cne.902550106
- Kernell D, Zwaagstra B. Input conductance, axonal conduction velocity and cell size among hindlimb motoneurones of the cat. Brain Res. 1981;204(2):311–326. doi: 10.1016/0006-8993(81)90591-6
- Mendell LM. The size principle: a rule describing the recruitment of motoneurons. J Neurophysiol. 2005;93(6):3024–3026. doi: 10.1152/classicessays.00025.2005
- Tremblay E, Martineau É, Robitaille R. Opposite synaptic alterations at the neuromuscular junction in an ALS mouse model: when motor units matter. J Neurosci. 2017;37(37):8901–8918. doi: 10.1523/JNEUROSCI.3090-16.2017
- Pun S, Santos AF, Saxena S, et al. Selective vulnerability and pruning of phasic motoneuron axons in motoneuron disease alleviated by CNTF. Nat Neurosci. 2006;9(3):408–419. doi: 10.1038/nn1653
- Bjornskov EK, Norris FH, Mower-Kuby J. Quantitative axon terminal and end-plate morphology in amyotrophic lateral sclerosis. Arch Neurol. 1984;41(5):527–530. doi: 10.1001/archneur.1984.04050170073021
- Tsujihata M, Hazama R, Yoshimura T, et al. The motor end‐plate fine structure and ultrastructural localization of acetylcholine receptors in amyotrophic lateral sclerosis. Muscle Nerve. 1984;7(3):243–249. doi: 10.1002/mus.880070310
- Palma E, Reyes-Ruiz JM, Lopergolo D, et al. Acetylcholine receptors from human muscle as pharmacological targets for ALS therapy. Proc Natl Acad Sci U S A. 2016;113(11):3060–3065. doi: 10.1073/pnas.1600251113
- Ding Q, Kesavan K, Lee KM, et al. Impaired signaling for neuromuscular synaptic maintenance is a feature of motor neuron disease. Acta Neuropathol Commun. 2022;10(1):61. doi: 10.1186/s40478-022-01360-5
- Dengler R, Konstanzer A, Küther G, et al. Amyotrophic lateral sclerosis: Macro–EMG and twitch forces of single motor units. Muscle Nerve. 1990;13(6):545–550. doi: 10.1002/mus.880130612
- Nijssen J, Comley LH, Hedlund E. Motor neuron vulnerability and resistance in amyotrophic lateral sclerosis. Acta Neuropathol. 2017;133(6):863–885. doi: 10.1007/s00401-017-1708-8
- Fischer LR, Culver DG, Tennant P, et al. Amyotrophic lateral sclerosis is a distal axonopathy: evidence in mice and man. Exp Neurol. 2004;185(2):232–240. doi: 10.1016/j.expneurol.2003.10.004
- Maselli RA, Wollman RL, Leung C, et al. Neuromuscular transmission in amyotrophic lateral sclerosis. Muscle Nerve. 1993;16(11):1193–1203. doi: 10.1002/mus.880161109
- Bonifacino T, Zerbo RA, Balbi M, et al. Nearly 30 years of animal models to study amyotrophic lateral sclerosis: a historical overview and future perspectives. Int J Mol Sci. 2021;22(22):12236. doi: 10.3390/ijms222212236
- Rosen DR, Siddique T, Patterson D, et al. Mutations in Cu/Zn superoxide dismutase gene are associated with familial amyotrophic lateral sclerosis. Nature. 1993;362(6415):59–62. doi: 10.1038/362059a0
- Gurney ME, Pu H, Chiu AY, et al. Motor neuron degeneration in mice that express a human Cu, Zn superoxide dismutase mutation. Science. 1994;264(5166):1772–1775. doi: 10.1126/science.8209258
- Bosco DA, Morfini G, Karabacak NM, et al. Wild-type and mutant SOD1 share an aberrant conformation and a common pathogenic pathway in ALS. Nat Neurosci. 2010;13(11):1396–1403. doi: 10.1038/nn.2660
- Huang C, Zhou H, Tong J, et al. FUS transgenic rats develop the phenotypes of amyotrophic lateral sclerosis and frontotemporal lobar degeneration. PLoS Genet. 2011;7(3):e1002011. doi: 10.1371/journal.pgen.1002011
- Verbeeck C, Deng Q, DeJesus-Hernandez M, et al. Expression of Fused in sarcoma mutations in mice recapitulates the neuropathology of FUS proteinopathies and provides insight into disease pathogenesis. Mol Neurodegener. 2012;7:53. doi: 10.1186/1750-1326-7-53
- Mitchell JC, McGoldrick P, Vance C, et al. Overexpression of human wild-type FUS causes progressive motor neuron degeneration in an age- and dose-dependent fashion. Acta Neuropathol. 2013;125(2):273–288. doi: 10.1007/s00401-012-1043-z
- Shelkovnikova TA, Peters OM, Deykin AV, et al. Fused in sarcoma (FUS) protein lacking nuclear localization signal (NLS) and major RNA binding motifs triggers proteinopathy and severe motor phenotype in transgenic mice. J Biol Chem. 2013;288(35):25266–25274. doi: 10.1074/jbc.M113.492017
- Yun Y, Ha Y. CRISPR/Cas9-mediated gene correction to understand ALS. Int J Mol Sci. 2020;21(11):3801. doi: 10.3390/ijms21113801
- Tsao W, Jeong YH, Lin S, et al. Rodent models of TDP-43: recent advances. Brain Res. 2012;1462:26–39. doi: 10.1016/j.brainres.2012.04.031
- Riemslagh FW, van der Toorn EC, Verhagen RFM, et al. Inducible expression of human C9ORF72 36× G4C2 hexanucleotide repeats is sufficient to cause RAN translation and rapid muscular atrophy in mice. Dis Model Mech. 2021;14(2):dmm044842. doi: 10.1242/dmm.044842
- Gould TW, Buss RR, Vinsant S, et al. Complete dissociation of motor neuron death from motor dysfunction by Bax deletion in a mouse model of ALS. J Neurosci. 2006;26(34):8774–8786. doi: 10.1523/JNEUROSCI.2315-06.2006
- Vinsant S, Mansfield C, Jimenez‐Moreno R, et al. Characterization of early pathogenesis in the SOD1G93A mouse model of ALS: part I, background and methods. Brain Behav. 2013;3(4):335–350. doi: 10.1002/brb3.143
- Hegedus J, Putman CT, Tyreman N, Gordon T. Preferential motor unit loss in the SOD1 G93A transgenic mouse model of amyotrophic lateral sclerosis. J Physiol. 2008;586(14):3337–3351. doi: 10.1113/jphysiol.2007.149286
- Khabibrakhmanov AN, Nurullin LF, Bogdanov EI, et al. Analysis of immunoexpression of synaptic proteins in neuromuscular junctions of symptomatic and presymptomatic mSOD1 transgenic mice with model of amyotrophic lateral sclerosis. BioNanoScience. 2020;10:375–380. doi: 10.1007/s12668-019-00711-2
- Giniatullin A, Petrov A, Giniatullin R. Action of hydrogen peroxide on synaptic transmission at the mouse neuromuscular junction. Neuroscience. 2019;399:135–145. doi: 10.1016/j.neuroscience.2018.12.027
- Smith EF, Shaw PJ, De Vos KJ. The role of mitochondria in amyotrophic lateral sclerosis. Neurosci Lett. 2019;710:132933. doi: 10.1016/j.neulet.2017.06.052
- Mukhamedyarov MA, Grigoryev PN, Khisamieva GA, et al. Dysfunction of neuromuscular synaptic transmission and synaptic vesicle recycling in motor nerve terminals of mSOD1 transgenic mice with model of amyotrophic lateral sclerosis. BioNanoScience. 2019;9:66–73. doi: 10.1007/s12668-018-0590-8
- So E, Mitchell JC, Memmi C, et al. Mitochondrial abnormalities and disruption of the neuromuscular junction precede the clinical phenotype and motor neuron loss in hFUSWT transgenic mice. Hum Mol Genet. 2018;27(3):463–474. doi: 10.1093/hmg/ddx415
- Picchiarelli G, Demestre M, Zuko A, et al. FUS-mediated regulation of acetylcholine receptor transcription at neuromuscular junctions is compromised in amyotrophic lateral sclerosis. Nat Neurosci. 2019;22(11):1793–1805. doi: 10.1038/s41593-019-0498-9
- Sharma A, Lyashchenko AK, Lu L, et al. ALS-associated mutant FUS induces selective motor neuron degeneration through toxic gain of function. Nat Commun. 2016;7:10465. doi: 10.1038/ncomms10465
- Sahadevan S, Hembach KM, Tantardini E, et al. Synaptic FUS accumulation triggers early misregulation of synaptic RNAs in a mouse model of ALS. Nat Commun. 2021;12(1):3027. doi: 10.1038/s41467-021-23188-8
- Salam S, Tacconelli S, Smith BN et al. Identification of a novel interaction of FUS and syntaphilin may explain synaptic and mitochondrial abnormalities caused by ALS mutations. Sci Rep. 2021;11(1):13613. doi: 10.1038/s41598-021-93189-6
- Chand KK, Lee KM, Lee JD, et al. Defects in synaptic transmission at the neuromuscular junction precede motor deficits in a TDP‐43 Q331K transgenic mouse model of amyotrophic lateral sclerosis. FASEB J. 2018;32(5):2676–2689. doi: 10.1096/fj.201700835R
- Clark JA, Southam KA, Blizzard CA, et al. Axonal degeneration, distal collateral branching and neuromuscular junction architecture alterations occur prior to symptom onset in the SOD1G93A mouse model of amyotrophic lateral sclerosis. J Chem Neuroanat. 2016;76(Pt A):35–47. doi: 10.1016/j.jchemneu.2016.03.003
- Turner BJ, Lopes EC, Cheema SS. Neuromuscular accumulation of mutant superoxide dismutase 1 aggregates in a transgenic mouse model of familial amyotrophic lateral sclerosis. Neurosci Lett. 2003;350(2):132–136. doi: 10.1016/S0304-3940(03)00893-0
- Dewil M, dela Cruz VF, Van Den Bosch L, Robberecht W. Inhibition of p38 mitogen activated protein kinase activation and mutant SOD1G93A-induced motor neuron death. Neurobiol Dis. 2007;26(2):332–341. doi: 10.1016/j.nbd.2006.12.023
- Wong M, Martin LJ. Skeletal muscle-restricted expression of human SOD1 causes motor neuron degeneration in transgenic mice. Hum Mol Genet. 2010;19(11):2284–2302. doi: 10.1093/hmg/ddq106
- Anakor E, Milla V, Connolly O, et al. The neurotoxicity of vesicles secreted by ALS patient myotubes is specific to exosome-like and not larger subtypes. Cells. 2022;11(5):845. doi: 10.3390/cells11050845
- Le Gall L, Duddy WJ, Martinat C, et al. Muscle cells of sporadic amyotrophic lateral sclerosis patients secrete neurotoxic vesicles. J Cachexia Sarcopenia Muscle. 2022;13(2):1385–1402. doi: 10.1002/jcsm.12945
- Jokic N, Gonzalez de Aguilar J, Dimou L, et al. The neurite outgrowth inhibitor Nogo‐A promotes denervation in an amyotrophic lateral sclerosis model. EMBO Rep. 2006;7(11):1162–1167. doi: 10.1038/sj.embor.7400826
- Bruneteau G, Bauché S, Gonzalez de Aguilar JL, et al. Endplate denervation correlates with Nogo-A muscle expression in amyotrophic lateral sclerosis patients. Ann Clin Transl Neurol. 2015;2(4):362–272. doi: 10.1002/acn3.179
- Bros-Facer V, Krull D, Taylor A, et al. Treatment with an antibody directed against Nogo-A delays disease progression in the SOD1G93A mouse model of amyotrophic lateral sclerosis. Hum Mol Genet. 2014;23(16):4187–4200. doi: 10.1093/hmg/ddu136
- Dupuis L, Loeffler JP. Neuromuscular junction destruction during amyotrophic lateral sclerosis: insights from transgenic models. Curr Opin Pharmacol. 2009;9(3):341–346. doi: 10.1016/j.coph.2009.03.007
- Dupuis L, Oudart H, René F, et al. Evidence for defective energy homeostasis in amyotrophic lateral sclerosis: benefit of a high-energy diet in a transgenic mouse model. Proc Natl Acad Sci U S A. 2004;101(30):11159–11164. doi: 10.1073/pnas.0402026101
- Martineau É, Arbour D, Vallée J, Robitaille R. Properties of glial cell at the neuromuscular junction are incompatible with synaptic repair in the SOD1 G37R ALS mouse model. J Neurosci. 2020;40(40):7759–7777. doi: 10.1523/JNEUROSCI.1748-18.2020
- Harrison JM, Rafuse VF. Muscle fiber-type specific terminal Schwann cell pathology leads to sprouting deficits following partial denervation in SOD1G93A mice. Neurobiol Dis. 2020;145:105052. doi: 10.1016/j.nbd.2020.105052
- Alhindi A, Shand M, Smith HL, et al. Neuromuscular junction denervation and terminal Schwann cell loss in the hTDP‐43 overexpression mouse model of amyotrophic lateral sclerosis. Neuropathol Appl Neurobiol. 2023;49(4):e12925. doi: 10.1111/nan.12925
- Winter F De, Vo T, Stam FJ, et al. The expression of the chemorepellent Semaphorin 3A is selectively induced in terminal Schwann cells of a subset of neuromuscular synapses that display limited anatomical plasticity and enhanced vulnerability in motor neuron disease. Mol Cell Neurosci. 2006;32(1-2):102–117. doi: 10.1016/j.mcn.2006.03.002
- Maimon R, Ionescu A, Bonnie A, et al. miR126-5p downregulation facilitates axon degeneration and NMJ disruption via a non-cell-autonomous mechanism in ALS. J Neurosci. 2018;38(24):5478–5494. doi: 10.1523/JNEUROSCI.3037-17.2018
- Mora JS, Genge A, Chio A, et al. Masitinib as an add-on therapy to riluzole in patients with amyotrophic lateral sclerosis: a randomized clinical trial. Amyotroph Lateral Scler Frontotemporal Degener. 2020;21(1-2):5–14. doi: 10.1080/21678421.2019.1632346
- Saini J, Faroni A, Reid AJ, et al. Cross‐talk between motor neurons and myotubes via endogenously secreted neural and muscular growth factors. Physiol Rep. 2021;9(8):e14791. doi: 10.14814/phy2.14791
- Ma G, Wang Y, Li Y, et al. MiR-206, a key modulator of skeletal muscle development and disease. Int J Biol Sci. 2015;11(3):345–352. doi: 10.7150/ijbs.10921
- Dobrowolny G, Martone J, Lepore E, et al. A longitudinal study defined circulating microRNAs as reliable biomarkers for disease prognosis and progression in ALS human patients. Cell Death Discov. 2021;7(1):4. doi: 10.1038/s41420-020-00397-6
- Nishimune H, Shigemoto K. Practical anatomy of the neuromuscular junction in health and disease. Neurol. Clin. 2018;36(2):231–240. doi: 10.1016/j.ncl.2018.01.009
- Zong Y, Jin R. Structural mechanisms of the agrin–LRP4–MuSK signaling pathway in neuromuscular junction differentiation. Cell Mol Life Sci. 2013;70(17):3077–3088. doi: 10.1007/s00018-012-1209-9
- Tu WY, Xu W, Zhang J, et al. C9orf72 poly-GA proteins impair neuromuscular transmission. Zool Res. 2023;44(2):331–340. doi: 10.24272/j.issn.2095-8137.2022.356
- Vilmont V, Cadot B, Vezin E, et al. Dynein disruption perturbs post-synaptic components and contributes to impaired MuSK clustering at the NMJ: implication in ALS. Sci Rep. 2016;6:27804. doi: 10.1038/srep27804
- White MA, Kim E, Duffy A, et al. TDP-43 gains function due to perturbed autoregulation in a Tardbp knock-in mouse model of ALS-FTD. Nat Neurosci. 2018;21(4):552–563. doi: 10.1038/s41593-018-0113-5
- Cantor S, Zhang W, Delestrée N, et al. Preserving neuromuscular synapses in ALS by stimulating MuSK with a therapeutic agonist antibody. Elife. 2018;7:e34375. doi: 10.7554/eLife.34375
- Pérez-García MJ, Burden SJ. Increasing MuSK activity delays denervation and improves motor function in ALS mice. Cell Rep. 2012;2(3):497–502. doi: 10.1016/j.celrep.2012.08.004
- Sengupta-Ghosh A, Dominguez SL, Xie L, et al. Muscle specific kinase (MuSK) activation preserves neuromuscular junctions in the diaphragm but is not sufficient to provide a functional benefit in the SOD1G93A mouse model of ALS. Neurobiol Dis. 2019;124:340–352. doi: 10.1016/j.nbd.2018.12.002
- Miyoshi S, Tezuka T, Arimura S, et al. DOK7 gene therapy enhances motor activity and life span in ALS model mice. EMBO Mol Med. 2017;9(7):880–889. doi: 10.15252/emmm.201607298