Полиморфные варианты гена SNCA и риск развития синуклеинопатий
- Авторы: Абрамычева Н.Ю.1, Карань Л.С.1, Протопопова А.О.1, Минаев И.В.1, Бердалина И.А.1, Федотова Е.Ю.1, Иллариошкин С.Н.1
-
Учреждения:
- Научный центр неврологии
- Выпуск: Том 19, № 1 (2025)
- Страницы: 43-52
- Раздел: Оригинальные статьи
- Статья получена: 25.10.2024
- Статья одобрена: 25.11.2024
- Статья опубликована: 03.04.2025
- URL: https://annaly-nevrologii.com/pathID/article/view/1220
- DOI: https://doi.org/10.17816/ACEN.1220
- ID: 1220
Цитировать
Аннотация
Введение. Большинство форм синуклеинопатий являются спорадическими и имеют многофакторную природу, что определяет участие различных факторов риска в их развитии. Как один из таких предрасполагающих генетических факторов рассматривается участие различных полиморфных вариантов гена SNCA.
Цель исследования: изучение влияния 16 однонуклеотидных полиморфных вариантов, локализованных в различных регуляторных областях гена SNCA, на риск развития в когорте пациентов российской популяции трёх основных форм синуклеинопатий: болезни Паркинсона (БП), деменции с тельцами Леви (ДТЛ) и мультисистемной атрофии (МСА).
Материалы и методы. В исследование были включены 73 пациента с БП, 46 с МСА, 10 с ДТЛ и 62 неврологически здоровых добровольца. Генотипирование 16 однонуклеотидных полиморфных вариантов (SNP) гена SNCA проводили методом прямого секвенирования по Сэнгеру на капиллярном генетическом анализаторе. Для коррекции ошибки при множественном попарном сравнении использовали поправку Беньямини–Хохберга.
Результаты. По результатам сравнительного анализа «диагноз–контроль» только 1 из 16 протестированных SNP (rs11931074), локализованный в области 3’-UTR гена SNCA, продемонстрировал связь с БП: минорный аллель T проявил тенденцию к увеличению риска развития БП (ОШ = 5,19; p < 0,05 (c поправкой Беньямини–Хохберга p = 0,6)). Для 11 из 16 SNP выявлена ассоциация с МСА. Минорный аллель 5 SNP из них (rs2619364, rs2619363, rs2619362, rs2619361, rs181489) снижал риск заболевания, а для 6 SNP (rs7687945, rs2301134, rs2301135, rs3756063, rs2736990, rs11931074) — повышал. Применение поправки Беньямини–Хохберга нивелировало значимость только одной из этих ассоциаций (rs181489).
Заключение. В результате проведённого исследования впервые генотипирована большая группа полиморфных вариантов, расположенных в различных регуляторных областях гена SNCA, и установлены значимые ассоциации с риском развития одной из форм синуклеинопатий — МСА — в российской популяции.
Ключевые слова
Полный текст
Введение
Синуклеинопатии — группа нейродегенеративных заболеваний, связанных с аномальным накоплением агрегатов белка α-синуклеина в нейронах, нервных волокнах или глиальных клетках. Считается, что в мире α-синуклеинопатиями страдают более 10 млн человек [1].
α-Синуклеин — небольшой белок, состоящий из 140 аминокислот [2, 3], широко представлен в мозге человека, главным образом в пресинаптических терминалях. В нормальных условиях α-синуклеин представлен в клетке в виде тетрамера, предположительно участвующего в процессах везикулярного транспорта и регуляции дофаминергической нейротрансмиссии [4], и имеет критическое значение для нормальной функции мозга [5]. α-Синуклеин относится к белкам, не обладающим стабильной вторичной структурой в растворах, и имеет склонность к агрегации. При повышенной концентрации α-синуклеина в растворе образуются нерастворимые фибриллы и дискретные сферические структуры, приводящие к гибели клеток [6].
Наиболее частой фенотипической формой синуклеинопатий является болезнь Паркинсона (БП) с распространённостью 100–200 случаев на 100 тыс. человек [7], реже встречаются мультисистемная атрофия (МСА) — 2–5 случаев на 100 тыс. человек [8] и деменция с тельцами Леви (ДТЛ) — 4,2–5,0% случаев всех деменций [9]. Исторически различие БП, МСА и ДТЛ основывалось на клинических проявлениях и нейропатологических признаках. В последующем активное изучение молекулярно-генетических основ данной группы нейродегенеративных заболеваний выявило наличие структурных особенностей белковых агрегатов для разных форм синуклеинопатий. В случае заболеваний с тельцами Леви (БП и ДТЛ) наблюдаются скрученные парные нити или множество связанных нитей, в случае МСА — перекрученные или прямые одиночные утолщённые нити [10]. МСА связана с преобладанием олигодендроглиальных включений α-синуклеина, тогда как агрегаты α-синуклеина при БП преимущественно накапливаются в нейронах [11].
На настоящий момент остаются открытыми многие вопросы, касающиеся патогенеза заболевания. Не определены факторы, приводящие к агрегации α-синуклеина и, следовательно, к нейродегенерации. В их числе рассматриваются генетические варианты, эпигенетические и транскрипционные процессы. Большинство форм синуклеинопатий являются спорадическими и имеют многофакторную природу, и только 10% случаев могут иметь отягощённый семейный анамнез. Проведённые в последнее время несколько крупных исследований по полногеномному анализу ассоциаций (genome-wide association studies, GWAS) при БП выявили ассоциацию заболевания с некоторыми полиморфными вариантами (single nucleotide polymorphism, SNP), расположенными в различных регуляторных областях гена SNCA, кодирующего α-синуклеин [12–14]. Однако роль большинства из этих ассоциированных SNP в регулировании экспрессии гена SNCA не изучена. Выявлены два значимых неравновесных блока сцепления, связанных с БП: один охватывает область промотора, второй — область 4-го интрона и регуляторную 3’-область гена SNCA [15, 16]. Полиморфные варианты 5’-области гена SNCA могут влиять на транскрипционную активность гена: например, было продемонстрировано, что SNP (rs3756063) ассоциирован с гипометилированием у пациентов с БП [17]. Полиморфные варианты регуляторной 3’-области в свою очередь могут играть роль в стабильности трансляции мРНК, влияя на связывание с соответствующей микроРНК, а также в альтернативном сплайсинге [12, 13, 18].
Отдельные SNP могут по-разному влиять на регулирование экспрессии гена SNCA: как в сторону её уменьшения, так и в сторону увеличения. Так, например, показана «защитная» функция генотипической комбинации 2 SNP (rs2736990 и rs356165), которая сильно коррелировала с низким уровнем матричной РНК [19]. В другом исследовании, напротив, продемонстрирована достоверная ассоциация минорного аллеля другого SNP (rs356168) с увеличением уровня экспрессии гена SNCA за счёт активации энхансерного элемента и, как следствие, усиленной транскрипции гена [20, 21].
Влияние полиморфных вариантов гена SNCA на развитие синуклеинопатий недостаточно изучено. В российской популяции исследований спектра SNP с охватом нескольких нозологий синуклеинопатий не проводилось, в других популяциях таких работ крайне мало. В связи с этим целью нашего исследования явилось изучение влияния 16 SNP гена SNCA на риск развития в когорте пациентов российской популяции 3 основных форм синуклеинопатий: БП, ДТЛ и МСА.
Материалы и методы
В исследование включены 73 пациента Научного центра неврологии с диагнозом БП, поставленным согласно критериям Международного общества по изучению болезни Паркинсона и расстройств движения [22], 46 пациентов с диагнозом МСА, из которых у 17 пациентов диагностирован мозжечковый тип (МСА-М), у 29 — паркинсонический тип (МСА-П) [23], и 10 пациентов с диагнозом ДТЛ, установленным согласно соответствующим критериям диагностики [9]. Для оценки когнитивного статуса пациентов использовали Монреальскую шкалу оценки когнитивных функций (MoCA). Контрольная группа состояла из 62 неврологически здоровых добровольцев. Группы были представлены преимущественно лицами славянской этнической принадлежности, проживающими на территории европейской части России. Перед проведением исследования все участники были ознакомлены с предстоящими процедурами и подписали информированное согласие. Протокол исследования одобрен Этическим комитетом Научного центра неврологии (протокол № 2-8/24 от 18.03.2024).
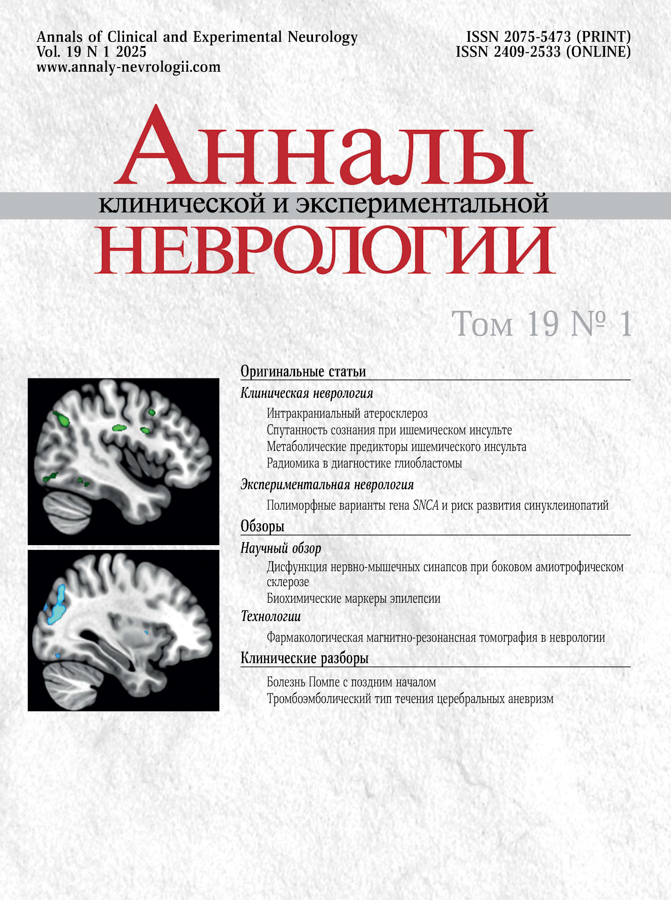
Основываясь на метаанализе нескольких крупных исследований по GWAS при БП в различных популяциях [24], мы отобрали 16 SNP, идентифицированных как значимо ассоциированные с развитием БП и локализованных в различных областях гена SNCA: 9 — в 5’-UTR и промоторной области; 2 — в области 4-го интрона; 5 — в области 3’-UTR (рисунок).
Структура гена SNCA и расположение 16 исследованных SNP.
Образцы геномной ДНК выделяли из цельной крови с помощью набора для выделения «ДНК-Экстран-1» («Синтол»). Генотипирование 16 SNP гена SNCA проводили методом прямого секвенирования по Сэнгеру на капиллярном генетическом анализаторе «Нанофор-05» (Институт аналитического приборостроения РАН).
Статистический анализ проводили с применением программного пакета «SPSS Statistics v. 26.0» («IBM»). Для коррекции ошибки при множественном попарном сравнении использовали поправку Беньямини–Хохберга (БХ). Нулевую гипотезу отвергали при скорректированном уровне значимости рadj < 0,05 по результатам оценки FDR. Для описания количественных переменных использовали среднее и стандартное отклонение, категориальных — абсолютные и относительные частоты. Сравнение групп по категориальным переменным проводили с помощью критерия χ2 Пирсона, а при наличии ограничений к его применению — с помощью точного критерия Фишера. Для количественной оценки связи между развитием заболевания и определёнными генотипами или аллелями рассчитывали отношение шансов (ОШ) и 95% доверительный интервал (ДИ).
Результаты
Исследуемые группы пациентов были охарактеризованы по клиническим и демографическим показателям (табл. 1). У 60 (82,2%) пациентов с БП выявлена смешанная форма заболевания, у 13 (17,8%) — акинетико-ригидная. У 41 (56,2%) пациентов была установлена 3-я стадия заболевания по шкале Hoehn–Yahr, у 23 (31,4%) — 2-я стадия, у 8 (11,0%) — 1-я стадия, у 1 (1,4%) — 4-я стадия. У 57 (78,1%) пациентов выявлено позднее начало заболевания (≥ 45 лет), а у 16 (21,9%) — раннее (21–44 лет).
Таблица 1. Клиническая и демографическая характеристика пациентов и обследуемых контрольной группы, M ± SD
Показатель | БП (n = 73) | МСА (n = 46) | ДТЛ (n = 10) | Контроль (n = 62) | |
МСА-П (n = 29) | МСА-М (n = 17) | ||||
Пол (М/Ж) | 38/35 | 11/18 | 8/9 | 9/1 | 44/18 |
Возраст, лет | 59,0 ± 11,6 | 64,1 ± 8,4 | 56,1 ± 6,6 | 70,2 ± 4,1 | 53,4 ± 9,8 |
Возраст начала заболевания, лет | 54,0 ± 11,4 | 59,7 ± 8,4 | 53,2 ± 7,2 | 66,0 ± 5,0 | – |
Балл по шкале MoCA | 23,9 ± 3,7 | 24,4 ± 3,6 | 24,3 ± 1,8 | 15,4 ± 3,8 | – |
В табл. 2 суммированы результаты по распределению частот встречаемости минорных аллелей для 3 фенотипических групп синуклеинопатий. Проведённый генетический скрининг выявил некоторые отличия для отдельных SNP по определению частоты минорного аллеля в нашей выборке по сравнению с европейской популяцией из международной базы данных с агрегированными сведениями о геномах (GnomAD). Согласно полученным результатам, распространённость минорных аллелей для SNP rs7687945, rs2301134, rs2301135 и rs2736990 в нашей контрольной группе была выше, чем в европейской популяции, по данным популяционных баз. Соответственно, сравнительный анализ частоты встречаемости проводили по аллелю риска, установленному для нашей выборки.
Таблица 2. Анализ ассоциации минорных аллелей SNP гена SNCA с наличием синуклеинопатий
SNP | Аллель | Группа | Частота аллеля | ОШ (95% ДИ) | p | padj |
rs7687945 | T | GnomAD | 0,52 | |||
Контроль | 0,41 | |||||
БП | 0,47 | 1,296 (0,795–2,115) | 0,321 | 1,000 | ||
МСА | 0,60* | 2,194 (1,252–3,845) | 0,008 | 0,020 | ||
ДТЛ | 0,31 | 0,659 (0,215–2,015) | 0,590 | 1,000 | ||
rs2619364 | G | GnomAD | 0,24 | |||
Контроль | 0,41 | |||||
БП | 0,38 | 0,891 (0,546–1,452) | 0,708 | 1,000 | ||
МСА | 0,18* | 0,311 (0,160–0,604) | < 0,001 | 0,005 | ||
ДТЛ | 0,10* | 0,159 (0,035–0,716) | 0,011 | 0,258 | ||
rs2619363 | T | GnomAD | 0,24 | |||
Контроль | 0,40 | |||||
БП | 0,36 | 0,872 (0,533–1,429) | 0,616 | 1,000 | ||
МСА | 0,18* | 0,331 (0,173–0,634) | 0,001 | 0,006 | ||
ДТЛ | 0,15* | 0,270 (0,075–0,971) | 0,044 | 0,301 | ||
rs2301134 | G | GnomAD | 0,52 | |||
Контроль | 0,39 | |||||
БП | 0,48 | 1,458 (0,897–2,370) | 0,141 | 1,000 | ||
МСА | 0,58* | 2,167 (1,247–3,766) | 0,008 | 0,021 | ||
ДТЛ | 0,40 | 1,056 (0,402–2,770) | 1,000 | 1,000 | ||
rs2301135 | C | GnomAD | 0,52 | |||
Контроль | 0,40 | |||||
БП | 0,48 | 1,360 (0,836–2,213) | 0,219 | 1,000 | ||
МСА | 0,60* | 2,241 (1,283–3,914) | 0,005 | 0,016 | ||
ДТЛ | 0,45 | 1,211 (0,468–3,135) | 0,807 | 1,000 | ||
rs2619362 | T | GnomAD | 0,23 | |||
Контроль | 0,40 | |||||
БП | 0,40 | 1,026 (0,627–1,679) | 1,000 | 1,000 | ||
МСА | 0,17* | 0,322 (0,169–0,616) | 0,001 | 0,005 | ||
ДТЛ | 0,15* | 0,270 (0,075–0,971) | 0,044 | 0,263 | ||
rs2619361 | A | GnomAD | 0,27 | |||
Контроль | 0,40 | |||||
БП | 0,40 | 1,026 (0,627–1,679) | 1,000 | 1,000 | ||
МСА | 0,17* | 0,322 (0,169–0,616) | 0,001 | 0,004 | ||
ДТЛ | 0,15* | 0,270 (0,075–0,971) | 0,044 | 0,234 | ||
rs3756063 | C | GnomAD | 0,40 | |||
Контроль | 0,40 | |||||
БП | 0,44 | 1,190 (0,731–1,939) | 0,535 | 1,000 | ||
МСА | 0,62* | 2,493 (1,433–4,337) | 0,002 | 0,007 | ||
ДТЛ | 0,40 | 1,020 (0,389–2,677) | 1,000 | 1,000 | ||
rs1372519 | A | GnomAD | 0,21 | |||
Контроль | 0,21 | |||||
БП | 0,17 | 0,738 (0,399–1,368) | 0,349 | 1,000 | ||
МСА | 0,21 | 0,961 (0,494–1,869) | 1,000 | 1,000 | ||
ДТЛ | 0,45* | 3,021 (1,132–8,063) | 0,046 | 0,221 | ||
rs2737029 | C | GnomAD | 0,40 | |||
Контроль | 0,47 | |||||
БП | 0,48 | 1,051 (0,647–1,708) | 0,902 | 1,000 | ||
МСА | 0,37 | 0,670 (0,385–1,167) | 0,164 | 0,225 | ||
ДТЛ | 0,28 | 0,440 (0,147–1,310) | 0,203 | 0,648 | ||
rs2736990 | A | GnomAD | 0,54 | |||
Контроль | 0,42 | |||||
БП | 0,44 | 1,064 (0,640–1,769) | 0,897 | 1,000 | ||
МСА | 0,60* | 2,045 (1,152–3,630) | 0,015 | 0,034 | ||
ДТЛ | 0,61 | 2,143 (0,769–5,969) | 0,199 | 0,683 | ||
rs356165 | G | GnomAD | 0,36 | |||
Контроль | 0,46 | |||||
БП | 0,54 | 1,393 (0,858–2,263) | 0,218 | 1,000 | ||
МСА | 0,39 | 0,765 (0,434–1,347) | 0,390 | 0,468 | ||
ДТЛ | 0,40 | 0,788 (0,300–2,066) | 0,809 | 1,000 | ||
rs356220 | T | GnomAD | 0,36 | |||
Контроль | 0,45 | |||||
БП | 0,52 | 1,327 (0,817–2,154) | 0,269 | 1,000 | ||
МСА | 0,38 | 0,743 (0,419–1,318) | 0,315 | 0,388 | ||
ДТЛ | 0,40 | 0,815 (0,311–2,137) | 0,809 | 1,000 | ||
rs11931074 | T | GnomAD | 0,07 | |||
Контроль | 0,02 | |||||
БП | 0,08* | 5,194 (1,139–23,688) | 0,025 | 0,595 | ||
МСА | 0,16* | 10,973 (2,424–49,672) | < 0,001 | 0,008 | ||
ДТЛ | 0,05 | 3,053 (0,264–35,339) | 0,377 | 0,953 | ||
rs356219 | G | GnomAD | 0,36 | |||
Контроль | 0,47 | |||||
БП | 0,53 | 1,285 (0,786–2,100) | 0,381 | |||
МСА | 0,37 | 0,672 (0,369–1,225) | 0,228 | 1,000 | ||
ДТЛ | 0,40 | 0,759 (0,290–1,985) | 0,635 | 0,296 | ||
rs181489 | T | GnomAD | 0,29 | |||
Контроль | 0,37 | |||||
БП | 0,40 | 1,135 (0,681–1,890) | 0,697 | 1,000 | ||
МСА | 0,23* | 0,495 (0,263–0,930) | 0,031 | 0,059 | ||
ДТЛ | 0,39 | 1,071 (0,385–2,980) | 1,000 | 1,000 |
Примечание. *Достоверные отличия от контроля.
Сравнительный анализ «диагноз–контроль» только 1 из 16 протестированных SNP (rs11931074) выявил связь с БП: минорный аллель увеличивал риск заболевания по сравнению с более распространённым аллелем. Однако применение поправки БХ нивелировало значимость этой ассоциации.
Одиннадцать из 16 SNP демонстрировали связь с МСА. Для 5 из них (rs2619364, rs2619363, rs2619362, rs2619361 и rs181489) минорный аллель снижал риск заболевания, а для 6 (rs7687945, rs2301134, rs2301135, rs3756063, rs2736990, rs11931074) — повышал. Применение поправки БХ нивелировало значимость только одной из этих ассоциаций (rs181489).
Пять из 16 SNP демонстрировали связь с ДТЛ. Для 4 из них (rs2619364, rs2619363, rs2619362, rs2619361) минорный аллель снижал риск заболевания, а для rs1372519 — повышал. Однако применение поправки БХ нивелировало значимость всех этих ассоциаций.
Для 11 SNP, продемонстрировавших значимую ассоциацию с МСА, проводили количественную оценку связи между наличием заболевания и статусом генотипа. С этой целью рассчитывали ОШ для 2 генетических моделей: доминантной и рецессивной (табл. 3). Анализ проводили как для суммарной группы МСА, так и для 2 основных подтипов: МСА-М и МСА-П.
Таблица 3. Анализ ассоциации генотипов SNP гена SNCA с наличием МСА (n = 46), отдельно МСА-П (n = 29) и МСА-М (n = 17) по сравнению со здоровыми добровольцами (n = 62)
SNP | Тип МСА | Доминантная модель | Рецессивная модель | ||
ОШ (95% ДИ) | padj | ОШ (95% ДИ) | padj | ||
rs7687945 | МСА | 6,833* (1,882–24,807) | 0,007 | 2,125 (0,805–5,610) | 0,215 |
МСА-П | 13,500* (1,709–106,648) | 0,029 | 1,545 (0,491–4,869) | 0,727 | |
МСА-М | 3,500 (0,724–16,922) | 0,207 | 3,400 (0,988–11,697) | 0,166 | |
rs2619364 | МСА | 0,265* (0,116–0,604) | 0,008 | NA | 0,025 |
МСА-П | 0,298 (0,115–0,772) | 0,054 | NA | 0,111 | |
МСА-М | 0,216 (0,066–0,707) | 0,128 | NA | 0,235 | |
rs2619363 | МСА | 0,283* (0,126–0,633) | 0,010 | NA | 0,043 |
МСА-П | 0,313 (0,125–0,782) | 0,054 | NA | 0,124 | |
МСА-М | 0,233 (0,071–0,758) | 0,083 | NA | 0,234 | |
rs2301134 | МСА | 6,045* (1,916–19,067) | 0,008 | 1,905 (0,715–5,079) | 0,289 |
МСА-П | 7,962* (1,731–36,619) | 0,038 | 1,536 (0,490–4,818) | 0,710 | |
МСА-М | 4,128 (0,860–19,816) | 0,164 | 2,677 (0,751–9,546) | 0,209 | |
rs2301135 | МСА | 7,000* (1,937–25,299) | 0,006 | 2,208 (0,838–5,821) | 0,215 |
МСА-П | 13,317* (1,688–105,050) | 0,024 | 1,683 (0,533–5,314) | 0,618 | |
МСА-М | 3,841 (0,802–18,397) | 0,201 | 3,212 (0,948–10,882) | 0,157 | |
rs2619362 | МСА | 0,273* (0,122–0,610) | 0,007 | NA | 0,041 |
МСА-П | 0,313* (0,125–0,782) | 0,050 | NA | 0,118 | |
МСА-М | 0,213 (0,066–0,686) | 0,108 | NA | 0,247 | |
rs2619361 | МСА | 0,273* (0,122–0,610) | 0,006 | NA | 0,040 |
МСА-П | 0,313* (0,125–0,782) | 0,047 | NA | 0,112 | |
МСА-М | 0,213 (0,066–0,686) | 0,090 | NA | 0,241 | |
rs3756063 | МСА | 7,883* (2,190–28,376) | 0,007 | 2,576 (1,001–6,631) | 0,104 |
МСА-П | 15,400* (1,960–120,995) | 0,022 | 1,874 (0,620–5,662) | 0,600 | |
МСА-М | 4,125 (0,863–19,718) | 0,160 | 4,122 (1,246–13,642) | 0,100 | |
rs2736990 | МСА | 2,449 (0,943–6,358) | 0,116 | 2,550 (1,020–6,372) | 0,117 |
МСА-П | 1,664 (0,597–4,635) | 0,658 | 2,567 (0,927–7,110) | 0,213 | |
МСА-М | 7,941 (0,969–65,065) | 0,093 | 2,520 (0,740–8,576) | 0,238 | |
rs11931074 | МСА | 11,952* (2,533–56,401) | 0,006 | NA | 0,500 |
МСА-П | 13,500* (2,678–68,064) | 0,022 | NA | NA | |
МСА-М | 9,500 (1,558–57,929) | 0,081 | NA | 0,250 | |
rs181489 | МСА | 0,313* (0,135–0,723) | 0,021 | NA | 1,000 |
МСА-П | 0,348 (0,133–0,910) | 0,121 | NA | 1,000 | |
МСА-М | 0,263 (0,084–0,816) | 0,082 | NA | 1,000 | |
Примечание. NA — невозможен расчёт ОШ (один из вариантов сравниваемых генотипов/их сочетаний не представлен как минимум в одной из групп) или уровня значимости (один из вариантов сравниваемых генотипов/их сочетаний не представлен в обеих группах).
*Достоверные отличия от данных здоровых добровольцев.
При анализе без деления на типы МСА для 5 SNP (rs7687945, rs2301134, rs2301135, rs3756063, rs11931074) в доминантной модели гомозиготный по минорному аллелю и гетерозиготный генотипы значимо повышали риск заболевания по сравнению с гомозиготами по более распространённому аллелю. Для 5 других SNP (rs2619364, rs2619363, rs2619362, rs2619361, rs181489) в доминантной модели гомозиготный по минорному аллелю и гетерозиготный генотипы значимо снижали риск заболевания по сравнению с гомозиготами по более распространённому аллелю. Для 4 из этих SNP (rs2619364, rs2619363, rs2619362, rs2619361) рецессивная модель показала значимо более редкую представленность гомозигот по минорному аллелю среди пациентов с МСА (а именно отсутствие таковых).
При анализе МСА-П также для 5 SNP (rs7687945, rs2301134, rs2301135, rs3756063, rs11931074) в доминантной модели гомозиготный по минорному аллелю и гетерозиготный генотипы значимо повышали риск заболевания по сравнению с гомозиготами по более распространённому аллелю. При этом только для 2 SNP (rs2619362, rs2619361) в доминантной модели гомозиготный по минорному аллелю и гетерозиготный генотипы значимо снижали риск заболевания по сравнению с гомозиготами по более распространённому аллелю. Рецессивная модель ни для одного из SNP не демонстрировала значимых различий представленности гомозигот по минорному аллелю между группами.
При анализе МСА-М ни в одной из моделей не выявлено значимых связей генотипов с наличием заболевания. Это может быть связано с малой мощностью анализа в связи с небольшим объёмом исследуемой группы (n = 17).
Обсуждение
В развитии многофакторных заболеваний в качестве одного из факторов риска рассматривается участие различных полиморфных вариантов генов, ассоциированных с заболеванием. Мы провели генетический скрининг 16 полиморфных вариантов гена SNCA для 3 групп различных форм синуклеинопатий, взяв за основу крупный метаанализ связи между полиморфизмами SNCA и риском развития БП, отобрав наиболее значимые SNP [24].
В ряде работ наибольшая ассоциация с риском развития идиопатической БП показана для rs11931074, локализованного в области 3’-UTR гена SNCA [12–14, 25]. Было предсказано, что rs11931074 может играть роль в стабильности мРНК и эффективности трансляции [12, 13, 18, 25, 26]. Результаты нашего исследования также показали, что минорный аллель (T) rs11931074 проявляет тенденцию к увеличению риска развития БП (ОШ = 5,19; p < 0,05 (padj = 0,6).
Для других 15 SNP мы не выявили ассоциации с риском развития БП на нашей выборке. По-видимому, это связано, в первую очередь, c гетерогенностью группы БП (как клинической картины, так и скорости прогрессирования заболевания), что не позволило заметить значимые ассоциации с отдельными формами этого заболевания. В дальнейшем для оценки связи полиморфизмов SNCA с БП необходимо конкретизировать группы БП по клиническим, динамическим, демографическим характеристикам и по возрасту дебюта заболевания. Кроме того, отмечается популяционная зависимость роли отдельных SNP в регулировании экспрессии гена SNCA. Например, повышение риска БП в восточно-азиатской группе связано с rs11931074, rs2736990 и rs356219, в европейской группе — с rs11931074, rs356219, rs181489, rs2737029 и rs356165 [24, 27–30]. Существуют единичные работы по изучению роли отдельных полиморфных вариантов гена SNCA в риске развития БП в российской популяции. Так, в одном из исследований продемонстрировано повышение уровня α-синуклеина в CD45+-клетках крови в российской группе БП, значимо ассоциированное с rs356168 и rs356219 [31].
При МСА из 16 проанализированных полиморфных вариантов гена SNCA статистически значимыми (p < 0,05) для риска развития заболевания оказались 11. В нашем исследовании наибольшее внимание мы уделили полиморфизмам, расположенным в промоторной и 5’-UTR областях гена SNCA, оказывающим влияние на транскрипционную активность гена. Восемь из 9 анализируемых SNP в этой области проявили ассоциацию с риском развития МСА для нашей когорты пациентов. Из них для 4 SNP (rs7687945, rs2301134, rs2301135 и rs3756063) наблюдалось увеличение риска развития МСА, которое подтверждено только для пациентов с паркинсоническим типом МСА в доминантной модели наследования, когда минорный аллель как в гомозиготном, так и в гетерозиготном состоянии оказывает влияние на развитие заболевания. Согласно данным Y. Wei и соавт., нуклеотидная замена G>C в полиморфизме rs3756063 приводит к появлению CpG в промоторной области, что может способствовать риску развития БП за счёт влияния на статус метилирования ДНК SNCA [32]. В другом многоцентровом исследовании выявлена связь rs7687945 с возрастом начала БП [33]. Ещё 4 SNP (rs2619361, rs2619362, rs2619363, rs2619364), для которых в нескольких исследованиях продемонстрированы значимые ассоциации с увеличением риска развития БП [24, 34], в нашем исследовании проявили протективную роль минорного аллеля этих SNP в отношении МСА (p < 0,05).
Из 2 проанализированных SNP, локализованных в некодирующей области 4-го интрона (rs2737029, rs2736990), только минорный аллель А rs2736990 проявил значимую ассоциацию (p = 0,034) с увеличением риска развития МСА. В азиатской популяции rs2736990 соотносят с риском БП, но не МСА [35]. В литературе этот SNP связывают с обогащением одного из вариантов сплайсинга SNCA, называемого SNCA-112, в котором отсутствует 5-й экзон [36–39].
Область 3’-UTR гена SNCA в нашем исследовании была представлена 5 SNP (rs356165, rs356220, rs11931074, rs356219, rs181489), из которых статистически значимым для МСА оказался только rs11931074: минорный аллель Т увеличивал риск развития заболевания (ОШ = 10,973; 95% ДИ 2,424–49,672; p < 0,001). Анализ генотипов для данного SNP выявил рост риска только для паркинсонической формы МСА в доминантной модели наследования (ОШ = 13,5; 95% ДИ 2,678–68,064; p = 0,022). В многоцентровых исследованиях европейской популяции также продемонстрирована ассоциация этого SNP с высоким риском развития МСА: ОШ (рецессивная модель) = 6,2 (95% ДИ 3,4–11,2; p = 5,5 × 10−12) [40] и ОШ (рецессивная модель) = 9,32 (95% ДИ 4,03–21,55; p < 0,00001) [41]. Однако следует отметить, что в одном из исследований GWAS, включившем 1030 пациентов европейской группы с МСА, риск rs11931074 не был подтверждён [42]. Авторы связывают это с возможными внутрипопуляционными различиями европейской группы. Для азиатской популяции не была выявлена ассоциация МСА с rs11931074 [27]. Кроме того, нами установлена тенденция к уменьшению риска развития МСА для rs181489 (ОШ = 0,495; 95% ДИ 0,263–0,930; p = 0,031).
Несмотря на малочисленность группы ДТЛ в нашей работе, нам удалось выявить тенденцию к снижению риска для 4 SNP (rs2619364, rs2619363, rs2619362, rs2619361) и ассоциацию rs1372519 с увеличением риска развития заболевания.
Таким образом, мы впервые проанализировали большую группу полиморфных вариантов, расположенных в различных регуляторных областях гена SNCA, на наличие ассоциаций с риском развития 3 форм синуклеинопатий (БП, МСА и ДТЛ) в российской популяции. Наше исследование имело несколько ограничений. Во-первых, небольшой объём исследуемой выборки и отдельных групп мог снижать мощность анализа, увеличивая вероятность невыявления значимых ассоциаций. Во-вторых, некоторые значимые ассоциации могли быть нивелированы строгой поправкой на множественные сравнения. Результаты оценки риска и его значимости также зависели от популяционных особенностей сформированной контрольной группы [40–42].
С учётом вышеуказанных ограничений в результате проведённого исследования нами установлены значимые ассоциации полиморфизмов SNCA с различными формами синуклеинопатий. Данная работа требует продолжения на больших, выверенных когортах пациентов в комплексных исследованиях по изучению роли генетических и эпигенетических факторов в регуляции экспрессии гена SNCA с учётом популяционных особенностей.
Об авторах
Наталья Юрьевна Абрамычева
Научный центр неврологии
Автор, ответственный за переписку.
Email: abramicheva@neurology.ru
ORCID iD: 0000-0001-9419-1159
канд. биол. наук, в. н. с., зав. молекулярно-генетической лабораторией 5-го неврологического отделения Института клинической и профилактической неврологии
Россия, 125367, Москва, Волоколамское шоссе, д. 80Людмила Станиславовна Карань
Научный центр неврологии
Email: abramicheva@neurology.ru
ORCID iD: 0000-0002-5927-460X
н. с. молекулярно-генетической лаборатории 5-го неврологического отделения Института клинической и профилактической неврологии
Россия, 125367, Москва, Волоколамское шоссе, д. 80Анна Олеговна Протопопова
Научный центр неврологии
Email: abramicheva@neurology.ru
ORCID iD: 0000-0002-2798-0331
м. н. с. молекулярно-генетической лаборатории 5-го неврологического отделения Института клинической и профилактической неврологии
Россия, 125367, Москва, Волоколамское шоссе, д. 80Иван Вячеславович Минаев
Научный центр неврологии
Email: abramicheva@neurology.ru
ORCID iD: 0000-0003-0728-8708
врач-невролог 5-го неврологического отделения Института клинической и профилактической неврологии
Россия, 125367, Москва, Волоколамское шоссе, д. 80Ирина Александровна Бердалина
Научный центр неврологии
Email: abramicheva@neurology.ru
ORCID iD: 0009-0001-8707-180X
статистик отдела подготовки кадров высшей квалификации Института медицинского образования и профессионального развития
Россия, 125367, Москва, Волоколамское шоссе, д. 80Екатерина Юрьевна Федотова
Научный центр неврологии
Email: abramicheva@neurology.ru
ORCID iD: 0000-0001-8070-7644
д-р мед. наук, в. н. с., руководитель 5-го неврологического отделения Института клинической и профилактической неврологии
Россия, 125367, Москва, Волоколамское шоссе, д. 80Сергей Николаевич Иллариошкин
Научный центр неврологии
Email: abramicheva@neurology.ru
ORCID iD: 0000-0002-2704-6282
д-р мед. наук, профессор, академик РАН, директор Института мозга, заместитель директора по научной работе
Россия, 125367, Москва, Волоколамское шоссе, д. 80Список литературы
- Ayers JI, Lee J, Monteiro O, et al. Different α-synuclein prion strains cause dementia with Lewy bodies and multiple system atrophy. Proc Natl Acad Sci U S A. 2022;119(6):e2113489119. doi: 10.1073/pnas.2113489119
- Maroteaux L, Campanelli JT, Scheller RH. Synuclein: a neuron-specific protein localized to the nucleus and presynaptic nerve terminal. J Neurosci. 1988;8(8):2804–2815. doi: 10.1523/JNEUROSCI.08-08-02804.1988
- Jakes R, Spillantini MG, Goedert M. Identification of two distinct synucleins from human brain. FEBS Lett. 1994;345(1):27–32. doi: 10.1016/0014-5793(94)00395-5
- Bartels T, Choi JG, Selkoe DJ. α-Synuclein occurs physiologically as a helically folded tetramer that resists aggregation. Nature. 2011;477(7362):107–110. doi: 10.1038/nature10324
- Cabin DE, Shimazu K, Murphy D, et al. Synaptic vesicle depletion correlates with attenuated synaptic responses to prolonged repetitive stimulation in mice lacking alpha-synuclein. J Neurosci. 2002;22(20):8797–8807. doi: 10.1523/JNEUROSCI.22-20-08797.2002
- Conway KA, Harper JD, Lansbury PT. Accelerated in vitro fibril formation by a mutant alpha-synuclein linked to early-onset Parkinson disease. Nat Med. 1998;4(11):1318–1320. doi: 10.1038/3311
- Peelaerts W, Bousset L, Van der Perren A, et al. α-Synuclein strains cause distinct synucleinopathies after local and systemic administration. Nature. 2015;522(7556):340–344. doi: 10.1038/nature14547
- Jellinger KA, Wenning GK. Multiple system atrophy: pathogenic mechanisms and biomarkers. J Neural Transm (Vienna). 2016;123(6):555–572. doi: 10.1007/s00702-016-1545-2
- McKeith IG, Boeve BF, Dickson DW, et al. Diagnosis and management of dementia with Lewy bodies: fourth consensus report of the DLB Consortium. Neurology. 2017;89(1):88–100. doi: 10.1212/WNL.0000000000004058
- Okuzumi A, Hatano T, Matsumoto G, et al. Propagative α-synuclein seeds as serum biomarkers for synucleinopathies. Nat Med. 2023;29(6):1448–1455. doi: 10.1038/s41591-023-02358-9
- Altay MF, Kumar ST, Burtscher J, et al. Development and validation of an expanded antibody toolset that captures alpha-synuclein pathological diversity in Lewy body diseases. NPJ Parkinsons Dis. 2023;9(1):161. doi: 10.1038/s41531-023-00604-y
- Satake W, Nakabayashi Y, Mizuta I, et al. Genome-wide association study identifies common variants at four loci as genetic risk factors for Parkinson’s disease. Nat Genet. 2009;41(12):1303–1307. doi: 10.1038/ng.485
- Simon-Sanchez J, Schulte C, Bras JM, et al. Genome-wide association study reveals genetic risk underlying Parkinson’s disease. Nat Genet. 2009;41(12):1308–1312. doi: 10.1038/ng.487
- International Parkinson Disease Genomics Consortium; Nalls NA, Plagnol V, Hernandez DG, et al. Imputation of sequence variants for identification of genetic risks for Parkinson’s disease: a meta-analysis of genome-wide association studies. Lancet. 2011;377(9766):641-649. doi: 10.1016/S0140-6736(10)62345-8
- Mueller JC, Fuchs J, Hofer A, et al. Multiple regions of alpha-synuclein are associated with Parkinson’s disease. Ann Neurol. 2005;57(4):535–541. doi: 10.1002/ana.20438
- Szwedo AA, Pedersen CC, Ushakova A, et al. Association of SNCA Parkinson’s disease risk polymorphisms with disease progression in newly diagnosed patients. Front Neurol. 2021;11:620585. doi: 10.3389/fneur.2020.620585
- Pihlstrom L, Berge V, Rengmark A, Toft M. Parkinson’s disease correlates with promoter methylation in the alpha-synuclein gene. Mov Disord. 2015;30(4):577–580. doi: 10.1002/mds.26073
- Bae B, Miura P. Emerging roles for 3’ UTRs in neurons. Int J Mol Sci. 2020;21(10):3413. doi: 10.3390/ijms21103413
- Linnertz C, Saucier L, Ge D, et al. Genetic regulation of alpha-synuclein mRNA expression in various human brain tissues. PloS One. 2009;4(10):e7480. doi: 10.1371/journal.pone.0007480
- Rhinn H, Qiang L, Yamashita T, et al. Alternative alpha-synuclein transcript usage as a convergent mechanism in Parkinson’s disease pathology. Nat Commun. 2012;3:1084. doi: 10.1038/ncomms2032
- Soldner F, Stelzer Y, Shivalila CS, et al. Parkinson-associated risk variant in distal enhancer of alpha-synuclein modulates target gene expression. Nature. 2016;533(7601):95–99. doi: 10.1038/nature17939
- Postuma RB, Berg D, Stern M, et al. MDS clinical diagnostic criteria for Parkinson’s disease. Mov Disord. 2015;30(12):1591–1601. doi: 10.1002/mds.26424
- Wenning GR, Stankovic I, Vignatelli L, et al. The Movement disorder society criteria for the diagnosis of multiple system atrophy. Mov Disord. 2022;37(6):1131–1148. doi: 10.1002/mds.29005
- Zhang Y, Shu L, Qiying Sun O, et al. A comprehensive analysis of the association between SNCA polymorphisms and the risk of Parkinson’s disease. Front Mol Neurosci. 2018;11:391. doi: 10.3389/fnmol.2018.00391
- Guhathakurta S, Bok E, Evangelista BA, Kim Y. Deregulation of α-synuclein in Parkinson’s disease: insight from epigenetic structure and transcriptional regulation of SNCA. Prog Neurobiol. 2017;154:21–36. doi: 10.1016/j.pneurobio.2017.04.004
- Jo S, Park KW, Yun Su Hwang YS. Microarray genotyping identifies new loci associated with dementia in Parkinson’s disease. Genes (Basel). 2021;12(12):1975. doi: 10.3390/genes12121975
- Chung SJ, Armasu SM, Biernacka JM, et al. Common variants in PARK loci and related genes and Parkinson’s disease. Mov Disord. 2011;26(2):280–288. doi: 10.1002/mds.23376
- Trotta L, Guella I, Soldà G, et al. SNCA and MAPT genes: independent and joint effects in Parkinson disease in the Italian population. Parkinsonism Relat Disord. 2012;18(3):257–262. doi: 10.1016/j.parkreldis.2011.10.014
- Wu-Chou Y, Chen Y, Yeh T, et al. Genetic variants of SNCA and LRRK2 genes are associated with sporadic PD susceptibility: a replication study in a Taiwanese cohort. Parkinsonism Relat Disord. 2013;19(2):251–255. doi: 10.1016/j.parkreldis.2012.10.019
- Chen YP, Wei Q, Ou RW, et al. Genetic variants of SNCA are associated with susceptibility to Parkinson’s disease but not amyotrophic lateral sclerosis or multiple system atrophy in a Chinese population. PLoS One. 2015;10(7):e0133776. doi: 10.1371/journal.pone.0133776
- Emelyanov A, Kulabukhova D, Garaeva L, et al. SNCA variants and alpha-synuclein level in CD45+ blood cells in Parkinson’s disease. J Neurol Sci. 2018;395:135–140. doi: 10.1016/j.jns.2018.10.002
- Wei Y, Yang N, Xu Q, et al. The rs3756063 polymorphism is associated with SNCA methylation in the Chinese Han population. J Neurol Sci. 2016;367:11–14. doi: 10.1016/j.jns.2016.05.037
- UK Parkinson’s Disease Consortium; Wellcome Trust Case Control Consortium; Spencer CA, et al. Dissection of the genetics of Parkinson’s disease identifies an additional association 5’ of SNCA and multiple associated haplotypes at 17q21. Hum Mol Genet. 2011;20(2):345–353. doi: 10.1093/hmg/ddq469
- Heckman MG, Soto-Ortolaza AI, Diehl NN, et al. Evaluation of the role of SNCA variants in survival without neurological disease. PLoS One. 2012;7(8):e42877. doi: 10.1371/journal.pone.0042877
- Guo XY, Chen YP, Song W. SNCA variants rs2736990 and rs356220 as risk factors for Parkinson’s disease but not for amyotrophic lateral sclerosis and multiple system atrophy in a Chinese population. Neurobiol Aging. 2014;35(12):2882.e1–2882.e6. doi: 10.1016/j.neurobiolaging.2014.07.014
- Beyer K. Alpha-synuclein structure, posttranslational modification and alternative splicing as aggregation enhancers. Acta Neuropathol. 2006;112(3):237–251. doi: 10.1007/s00401-006-0104-6
- Beyer K, Ariza A. α-Synuclein posttranslational modification and alternative splicing as a trigger for neurodegeneration. Mol Neurobiol. 2013;47(2):509–524. doi: 10.1007/s12035-012-8330-5
- McCarthy JJ, Linnertz C, Saucier L, et al. The effect of SNCA 3’ region on the levels of SNCA-112 splicing variant. Neurogenetics. 2011;12(1):59–64. doi: 10.1007/s10048-010-0263-4
- Fang J, Hou B, Hongxin Liu H, et al. Association between SNCA rs2736990 polymorphism and Parkinson’s disease: a meta-analysis. Neurosci Lett. 2017;658:102–107. doi: 10.1016/j.neulet.2017.08.051
- Scholz SW, Houlden H, Schulte C, et al. SNCA variants are associated with increased risk for multiple system atrophy. Ann. Neurol. 2009;65(5):610–614. doi: 10.1002/ana.21685
- Ross OA, Vilariño-Güell C, Wszolek ZK, et al. Reply to: SNCA variants are associated with increased risk of multiple system atrophy. Ann Neurol. 2010;67(3):414–415. doi: 10.1002/ana.21786
- Sailer A, Scholz SW, Nalls MA, et al. A genome-wide association study in multiple system atrophy. Neurology. 2016;87(15):1591–1598. doi: 10.1212/WNL.0000000000003221